نانودارورسانی به مغز با اسب تروا
مقدمه
مغز دارای یکی از بهترین سیستمهای امنیتی در بدن است، بهطوریکه از طرف خارج بهوسیلهی جمجمه و از داخل، بهوسیلهی سد خونی- مغزی (BBB) محافظت میشود.
وظیفه BBB بقای هموستاز مغز، و ایجاد محیطی بیهمتا برای مایع خارج سلولی سیستم اعصاب مرکزی (CNS) است، و قادر است تا ترکیبات آن را بهطور بسیار دقیقی کنترل نماید. مناطقی ازCNS که حاوی مایع خارج سلولی است، عبارتند از: مغز، آب میان بافتی موجود در سلولهای پارانشیمال طناب نخاعی، مایع مغزی نخاعی بطنهای مغز و همچنین فضای تحت عنکبوتیه مغزی و نخاعی.
ساختمان BBB از سلولهای اندوتلیال مویرگهای مغز و نخاع تشکیل شده است. مشخصه این سلول ها، وجود اتصالات فشردهای است که در پیرامون آنها بهطور پیوسته قرار گرفته و آنها را محکم به یکدیگر متصل کرده است، و در نتیجه، مانع از ایجاد هر نوع مسیر آب گذری، بین این سلولها میشود. وجود اتصالات فشرده و نبود گذرگاههای آبی بین سلولی، به شدت حرکت مواد قطبی محلول در آب را از طریق سلولهای اندوتلیال مغز محدود میکند.
البته مواد معینی وجود دارند که میتوانند بهصورت غیر فعال از طریق سلولهای اندوتلیال مغز انتشار یابند. این انتشار بستگی به میزان چربی دوستی و وزن مولکولی آنها دارد. داروهایی که دارای وزن مولکولی بالای 500 دالتون هستند بهطور طبیعی قادر به انتشار غیر فعال از طریق BBB نیستند.
گر چه تعداد زیادی از داروها، که دارای وزن مولکولی و خاصیت چربی دوستی مناسبی هستند، بهطور طبیعی و به آسانی از BBB عبور میکنند، اما، به سرعت بهوسیلهی پمپهای رو به خارج بسیار قوی به جریان خون برمی گردند.
از میان این سیستمهای تلمبهای میتوان از پلی گلیکوپروتئین (Pgp) ، پروتئین مقاوم چند دارویی (MDR) ، و نیز MOAT (حامل آنیونهای آلی چندگانه) نام برد. از آنجائیکه مغز برای انتقال مواد و همچنین دفع زائدات حاصل از سوخت و ساز خود، به خون وابسته است، سلولهای اندوتلیال باید قادر باشند تا به منظور تبادلات محیط داخلی و خارجی، و دفع مقادیر متنوعی از ترکیبات درونساز مانند مواد آب دوست (قندهای شش کربنی4، آمینو اسیدها، ترکیبات پورین، و مواد مونوکربنی)، و لیپوپروتئینها (LDL) بهعنوان واسطههای حمل مواد عمل کنند.
برخی از این حاملها مواد را بهطور یکطرفه و برخی دوطرفه از غشاء سلول منتقل میکنند. پس بعضی از مواد محلول بهطور دو قطبی عمل میکنند، یعنی دارای این امتیاز هستند که میتوانند هم به مغز وارد وهم از آن خارج شوند. نتیجه میگیریم که،BBB مانع بزرگی برای رساندن مقادیر موثر دارو به مغز و درمان آن است و بنابراین، تلاش زیادی میطلبد تا بتوان براین حصار غلبه کرد.
بهعنوان مثال میتوان، از طریق فشار تراوشی این اتصالات فشرده را گشود، و یا با استفاده از پیشداروها یا سیستمهای حامل مانند آنتی بادیها، لیپوزومها و نانوذرات بر این امر فائق آمد. در هر صورت، گشودن این اتصالات فشرده از طریق فشار تراوشی یک روش بسیار تهاجمی است که باعث ورود مواد ناخواسته به داخل مغز میشود.
استفاده از پیشداروها میتواند باعث افزایش چربی دوستی و نفوذ و ترابری بهتر مواد از حصار سلولهای آندوتلیال چربیدوست، شود، همچنین این پیشداروها میتوانند از سیستمهای حامل وابسته به غشاء استفاده نمایند. به هر حال در بسیاری از موارد، یا نمیتوان یک پیشداروی مناسب تولید کرد و یا اینکه مولکول ساخته شده بسیار بزرگ است.
حاملهای کلوئیدی، در مقایسه با سایر سیستمهای حامل در BBB، از مزایای بیشتری برخوردار هستند. برای مثال گیرندههای لیپوپروتئینی و سیستمهای ترانس سیتوز ترانسفرین از این گروه هستند که میتوانند بهعنوان سیستمهای دارورسانی سریشمی (کلوئیدی) ذرهای مورد استفاده قرار بگیرند.
نانوذرات
نانوذرات از منظر داروسازى، طبق تعریف دانشنامه فناورى داروسازى عبارتند از ذرات سریشمى جامد که از ماکرومولکولها ساخته شدهاند و داراى ابعاد 1 تا 1000 نانومتر( 1 میکرون)، هستند.
قسمت اصلى و فعال آنها (دارو یا مواد فعال بیوزیستى)، نا محلول، طعمه گونه و کپسول دار هستند و یا اینکه این قسمت ها، بهطور جداگانه به آنها متصل شده است. در سال 1980 ، پروفسور اسپیسر براى اولین بار استفاده از نانوذرات را براى عبور داروها از BBB در انستیتو فناورى فدراتیو سوئیس در زوریخ مطرح کرد. او اولین کسى است که از سال 1960 تا 1970 ، بهطور اصولى و قاعدهمند، روى این موضوع کار کرد و باعث پیشرفت آن شد.
در ابتدا براى نشان دادن امکان انتقال داروها بهوسیلهى نانوذرات BBB ، از هگزا پپتید دالارگین (Tyr-D-Ala-Gly-Phe-Leu-Arg) استفاده شد، که به نانوذرهاى در ابعاد 250 نانومتر، تحت عنوان پلى بوتیل سیانوآکریلات، که از تجزیه پذیرترین مواد زیستى است، متصل شده بود. نانوذرات را براى مدت 4 ساعت با این دارو پرورده کردند.
نتیجه کار، اتصال 40 درصد از دالارگین اولیه بود. سپس این ذرات را با سورفاکتانت پلى براى مدت 30 دقیقه پروراندند بهطوریکه بین قسمت اتصالى پلى سوربات با قسمت محلول آن تعادل بر قرار شد. ماده حاصل را از طریق ورید به موش تزریق کردند و اثر ضد درد وابسته به دوز آن را به دو روش تست ضربه – دم و تست صفحه داغ بررسى کردند.
ده دقیقه قبل از تزریق این ترکیب، از آنتاگونیست گیرنده افیونى ? نالوکسان بهصورت داخل وریدى استفاده شد، و در نتیجه از اثر ضد درد نالوکسان بهطور کامل جلوگیرى شد. هر دو آزمایش، نشان داد که دالارگین توانسته است بهطور مرکزى و نه محیطى ،بر CNS اثر بگذارد و ثابت کرد که دالارگین توانسته است از BBB عبور کند.
در مقایسه با نانوذرات پوشیده شده با پلى سوربات 80 ، هیچکدام از گروه کنترل نتوانستند اثر ضد درد خود را اعمال کنند.
گرو ههاى کنترل عبارت بودند از: 1- محلول دالارگین؛ 2- محلول پلى سوربات -3 سوسپانسیون نانوذرات پلى بوتیل سیانو آکریلات؛ 4- مخلوط دالارگین و پلى سوربات 80؛ 5 -دالارگین به همراه نانوذرات؛ 6- مخلوط ؛ دالارگین، پلى سوربات 80 و نانوذرات که قبل از تزریق بهخوبى با هم آمیخته شدند؛ 7- دالارگین. متصل به نانوذرات بدون حضور پلى سوربات 80.
توزیع زیستى
نقش سورفاکتانت در توزیع نانوذرات در محیط هاى زیستمند.
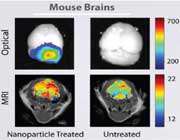
مطالعات مهمى که تروستر و همکارانش در خصوص نحوه توزیع ذرات[نانو پلى متیل متاکریلات] C انجام دادند، ثابت کرد که روکش کردن نانوذرات با سورفاکتانتهایى معین، باعث میشود تا بعد از تزریق وریدى، نانوذرات در مغز موش (صحرایى) تجمع پیدا کنند.
نانوذرات با روکش پلى سوربات 80 تا 3 برابر بیشتر از محلول دالارگین در فضاى همگون مغز تجمع پیدا کردند. نانوذرات روکش شده با پلى سوربات 80 بیشترین غلظت داکسوروبایسین را g/g?) 6 بافت مغز) ظرف مدت 2 تا 4 ساعت درمغز، ایجاد کردند.
این غلظت حتى 8 ساعت بعد از تزریق در حد g/g? 1 باقى ماند، در صورتیکه سه ترکیب دیگر در سرتاسر زمان آزمایش حتى غلظتشان به حد قابل تشخیص 0/1 g/g?) ) هم نرسید. این 4 محصول اختلاف غلظت ناچیزى را در خون نشان دادند. نکته بسیار جالبى هم در مطالعه کوریر و همکارانش بهدست آمد که ثابت میکرد غلظت دو فراورده حاوى نانوذرات در قلب به مقدار قابل توجهى کاهش مییابد، اما هم زمان غلظت دو فراورده فاقد نانوذرات در قلب 17 برابر بوده است.
از آنجائیکه استفاده از داکسوروبایسین در قلب به جهت تجمع و اثر سمى بالایى که دارد با محدودیت مواجه است این مشاهده بسیار حائز اهمیت است.
نانوذرات جامد لیپید (SLN) هم میتوانند، بعد از مصرف از طریق داخل وریدى و حتى از طریق دئودنوم(دوازدهه) غلظت قابل توجهى در مغز ایجاد کنند.
غلظت داکسوروبایسین متصل به SLN در مغز mg/kg 6 بعد از 180 دقیقه به ?g/g 2در بافت مغز میرسد این در شرایطى است که بعد از مصرف محلول داکسوروبایسین به تنهایى که از طریق ورید جوگولار به موش تزرق شد هیچ اثرى از داکسوروبین در مغز پیدا نشد.
انواع مختلفى از نانوذرات جامد لیپید با اندازهاى حدود 100 نانومتر به وسیلهى لاکمن و کوزیار و همکارانشان ساخته و در جریان خون مغز موش تزریق شد و سپس میزان جذب آنها بهوسیلهی ساکروز و با استفاده از روشهاى آمارى با هم مقایسه شد و مشاهده گردید که این ذرات توانستهاند بهوسیلهی سیستم اعصاب مرکزى دریافت شوند. در عین حال، تزریق نانوذرات هیچ تغییرى در یکپارچگى سد مغزى– خونى و نفوذپذیرى غشاء و یا حتى در انتقال تسهیل شده کولین، ایجاد نکرد.
تومورهاى مغزى
تومورهاى مغزى، مخصوصاً گلیوماى بدخیم از تهاجم ىترین سرطانهایى است که انسان با آن مواجه است. علیرغم پیشرفتهایى که در فناورى جراحى اعصاب، درمانهاى حمایتى با شیمى درمانى و پرتودرمانى بهدست آمده، اما سیر بهبودى در این بیماران هنوز بسیار ناخوشایند است.
از مشخصههاى این تومورها رشد سریع، انتشار و تهاجم به نقاط دورتر مغز است، علاوهبر این ورم وسیع مغزى و مقادیر زیادى از روند رگ سازى نیز مشاهده میشود. با وجود اینکه سد مغزى- خونى (BBB) در قسمت هسته و مرده (نکروز) تومور، بهطور واضحى شکسته میشود ولى این اتفاق در حاشیه رو به رشد تومور انجام نمیپذیرد.
به همین دلیل داروهاى ضد سرطان از قبیل داکسوروبایسین فقط میتوانند به قسمت مرده تومور نفوذ کنند و دارو به قسمتهاى محیطی تریا اصلاً نمیرسد و یا دسترسى بسیار ناچیزى دارد.
همانطور که در بالا گفته شد، این دارو در شرایطى که به نانوذرات پلى بوتیل سیانو آکریلات متصل باشد میتواند به سرعت به غلظتى حدود 6 میکروگرم به ازاء هر گرم در بافت مغز برسد. این نانوذرات در موشهایى که در داخل جمجمه آنها تومور گلیوبلاستوما 101 پیوند زده شده بود، 101آزمایش شد.
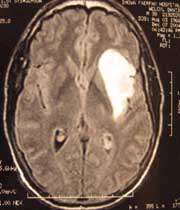
در روزهاى دوم، پنجم و هشتم بعد از پیوند تومور، ترکیب [داکسوروبایسین - نانوذرات پلى بوتیل سیانوآکریلات - پلى سوربات 80 ] با دوز1/5mg/kg به موش تزریق شد، در نتیجه متوسط عمر 85 درصد افزایش یافت و با تکرار آن، 20 تا 40 درصد از حیوانات تا 180 روز عمر کردند. سپس حیوانات کشته شدند و در بررس ىهاى بافتشناسى عدم وجود تومورها در این حیوانات به اثبات رسید.
در مقایسه با گروههاى کنترل یعنی [نانوذرات پلى بوتیل سیانوآکریلات - پلى سوربات80 ]، محلول [داکسوروبایسین - نانوذرات پلى بوتیل سیانوآکریلات]، افزایشى در طول عمر و تعداد موشهاى زنده مانده مشاهده نشد و یا بسیار ناچیز بود. هیچ سمیتى از نانوذرات در بافتشناسى دیده نشد. همچنین اثر سمى محلول داکسوروبایسین که معمولاً در سایر دستگاههاى بدن مشاهده میشود در اتصال با نانوذرات کاهش پیدا کرد.
سازوکار دارورسانى بهوسیلهى نانوذرات از طریق سد خونى- مغزى
در حال حاضر سازوکار دارورسانى بهوسیلهى نانوذرات از طریق BBB بهطور کامل روشن نشده است. اما فرضیههاى متعددى مطرح است که در ذیل به آنها اشاره میشود:
1. افزایش نانوذرات در مویر گهاى مغز متعاقباً باعث افزایش جذب آنها بهوسیلهى دیوارههاى مویرگ میشود. این عمل یک شیب غلظتى ایجاد میکند و باعث میشود این ذرات از جدار سلولهاى آندوتلیال عبور کرده و در نهایت به مغز برسد.
2. پلى سوربات 80 در نقشى که بهعنوان یک روکش براى نانوذرات دارد، میتواند از سیستم انتشار برگشت، مخصوصاً از عمل پلی گلیکوپروتئین. (Pgp) جلوگیرى کند.
3. با اعمال اثر سمى بر روى عروق مغز، باعث افزایش نفوذپذیرى سلولهاى اندوتلیال میشود.
4. یک اثر عمومى مشابه اثر سورفاکتانت، باعث حل شدن لیپیدهاى موجود در غشاء سلولى میشود و در نتیجه غشاء بهصورت مایع در آمده و باعث افزایش نفوذپذیرى دارو از طریق سد مغزى- خونى میشود.
5. ذرات نانو میتوانند یک شکاف در اتصالات فشرده بین سلولهاى اندوتلیال ایجاد نمایند. سپس داروها به تنهایى یا بهصورت متصل به ذرات نانو، از آن شکاف عبور میکنند.
6. ممکن است نانوذرات به روش اندوسیتوز بهوسیلهى سلولهاى اندوتلیال بلعیده شوند و سپس داروها در داخل سلولها رها شده و از این طریق به مغز برسند.
7. ذرات نانو به همراه داروى متصل شده به روش ترانس سیتوز از لایه سلولهاى اندوتلیال عبور میکنند.
8. تمام این سازوکارها میتوانند با هم عمل کنند.
سازوکارهاى 1 و 2 بعید به نظر میرسد زیرا: اگر نانوذراتى که حامل دارو هستند از طریق چسبیدن به دیواره داخلى مویرگ و با ایجاد یک شیب غلظتى بالا عبور کرده باشند (سازوکار 1 )، انتشار دارو هنوز میتواند در سیطره حاملهاى خارج کننده اى باشد که در غشاءهاى آندوتلیال سلولها وجود دارند. از طرف دیگر، اگر پلى سوربات 80 بتواند این حاملها را مهار کند (سازوکار 2 )، تزریق نانوذرات با روکش پلى سوربات 80 به تنهایى 5 یا 30 دقیقه قبل از تزریق دالارگین، باید باعث تسکین درد شود، که در این آزمایش مشاهده نشد. این نظر که سازوکار 1 و 2 در عمل اتفاق نمیافتد، بهوسیلهى مطالعاتى هم که کوزیارا بر روى مغز انجام داد، تأیید شد.
فرضیههاى 3 و 5 نیز رد مى شوند، زیرا هیچ اثر ضد دردى بعد از تزریق پلى سوربات 80 (فاقد نانوذرات) مشاهده نشد.
علاوه بر این، هیچ پاسخ ضد دردى بعد از تزریق نانوذرات – دالارگین با روکش سورفاکتانتهاى دیگر بهدست نیامد (سازوکار شماره 4، مایع شدن عمومى غشاء).
این عقیده که علت انتقال دارو بهوسیلهى نانوذرات از BBB به جهت ایجاد اثر سمى بر غشاء نیست در مطالعات سان و کوزیرا ثابت شد . پوشاندن تنها قسمتى از نانوذرات بهوسیلهى پلى سوربات 80 براى دارورسانى به مغز کافى است، مطالعات خونرسانى بافتهاى مغز نشان داد که نانوذرات نمیتوانند هیچ تغییر واضحى در یکپارچگى BBB نفوذپذیرى غشاء و یا در سیستم ، انتقال تسهیل شده کولین ایجاد کنند.
تئورى ایجاد شکاف در اتصالات فشرده که اساس سازوکار 5 را تشکیل میداد بهوسیلهى یافتههایى که هیچگونه افزایشى را در فضاهاى اینولین نشان نمیداد، رد شد، علاوه بر این، میکروسکوپ الکترونى هم هیچ شکاف واضحى را در اتصالات فشرده نشان نداد .
بنابراین محتملترین سازوکار، به نظر میرسد که سازوکار 6 (دریافت نانوذرات حامل دارو بهوسیلهى اندوسیتوز باشد. این سازوکار قبلا در محیط آزمایشگاهى با بافتهاى کشت داده شده سلولهاى اندوتلیال مغز انسان، گاو، خوک، موش خانگى و موش صحرایى نشان داده شده بود در دماى یکنواخت C 37° ، مشاهده شد که نانوذراتى که با پلى سوربات 80 روکش شدهاند با سرعت و بهطور قابل ملاحظهاى بهوسیلهى این سلولها برداشت میشوند، در صورتیکه در نمونه بدون روکش بسیار ناچیز بود و در دماى 4°C (دمایى که در آن فاگوسیتوز انجام نمیشود) و یا بعد از مصرف سیتوکالازین B بازدارنده قوى فاگوسیتوز) متوقف شد.
کریتر بعداً نشان داد که نانوذرات متصل به دالارگین حتى میتوانند بعد از جذب آپولیپوپروتئینE و B اثرات ضد دردى خود را اعمال نمایند. این اثر حتى بعد از پروراندن پلى سوربات 80 بسیار افزایش یافت. بنابراین سناریوى زیر را میتوان مطرح کرد: نانوذرات به جهت داشتن روکش پلى سوربات بعد از تزریق در خون میتوانند آپولیپوپروتئین E و یا B را جذب کنند.
پس این ذرات در نقش ذرات لیپوپروتئین ظاهر شده و بهوسیلهى سلولهاى آندوتلیال مغز که داراى مقادیر بسیار زیادى از گیرندههاى لیپوپروتئینى هستند به روش آندوسیتوز وابسته به گیرنده، جذب میشوند. با توجه به اینکه حاملهاى انتشار دهنده عمدتاً بر روى غشاء لومینال (مجرایى) قرار دارند، دارو میتواند بعد از رها شدن از ذرات پلیمر (این ذرات بسیار تجزیهپذیر هستند)، بهوسیلهى فرایند انتشار به داخل مغز منتقل شود .
اگر چه هنوز هیچ مدرک محکمى در دست نیست ولى این احتمال هم وجود دارد که نانوذرات بتوانند به روش ترانس سیتوز(سازوکار 7 ) از سلولهاى اندوتلیال عبور کنند. بنابراین به نظر میرسد که ذرات نانو، نقش « اسب تروا» را در اینجا ایفاء میکنند.
این فرضیه که دارو از طریق آندوسیتوز نانوذرات به این سلولها ارائه میشود بهوسیلهى سان، کوزیرا و گسنر تأیید شده است. از آنجائیکه گیرندههاى لیپوپروتئین بهوضوح در تومورهاى مغزى وجود دارند ، سناریوى پیشنهادى بالا، عمل متقابل گیرندههاى لیپوپروتئین و اثربخشى ترکیب [پلى سوربات 80 – داکسوروبایسین – ذرات نانو] را به خوبى نشان میدهد.
نتیجهگیرى
نانوذرات پلى سیانوآکریلات یا نانوذرات جامد لیپید قادر هستند، بسیارى از داروهاى ضرورى را که در شرایط معمولى نمیتوانند از سد مغزى - خونى عبور کنند، از این مسیر منتقل نمایند.
از نانوذرات همچنین میتوان براى رساندن ترکیبات بزرگتر و مولکولهاى پیچیدهتراز قبیل پروتئینها، اسیدهاى نوکلئیک و ژنها براى گذشتن BBB از استفاده کرد. آنها حتى میتوانند باعث بهبودى در درمان تومورهاى مغزى شوند چرا که با اتصال نانوذرات روکش شده با پلى سوربات 80 میتوان داروهاى ضد تومور را از سد نفوذ ناپذیر BBB ،عبور داد. در نتیجه م ىتوان به مکانهایى که براى اکثر داروهاى ضد سرطان دور از دسترس است، دست یافت.
اگر چه سازوکار انتقال نانوذرات حامل دارو از BBB هنوز کاملاً روشن نشده است، اما به نظر میرسد که بعد از تزریق به جریان خون و اتصال با آپولیپوپروتئینها، ابتدا به سلولهاى اندوتلیال مویرگهاى مغز متصل میشوند و به دنبال آن از طریق اندوسیتوز (با واسطه گیرنده ها) وارد سلولهاى اندوتلیال میشوند. این محتملترین اسب » سازوکار مطرح است. بنابراین نانوذرات مانند «اسب تروا» عمل میکند که میتواند داروها را در داخل این سلولها و یا بعد از ترانس سیتوز، به داخل مغز رها کند.
منبع: ماهنامه فناوری نانو